图文导读
催化剂的设计和表征
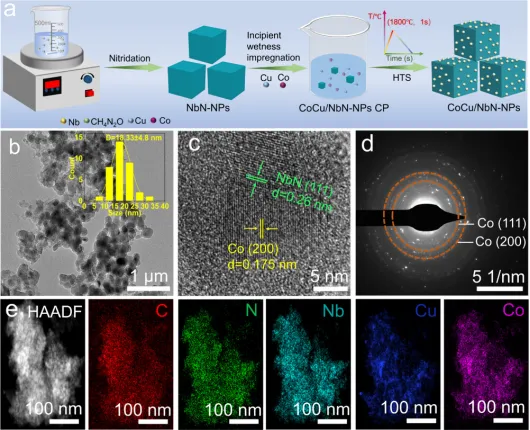
Figure 1. (a) Schematic diagram for the synthesis of CoCu/NbNNPs. (b) TEM image (inset: particle size distribution), (c) HR-TEMimage, (d) SAED pattern, and (e) HAADF-STEM and thecorresponding EDS elemental mappings of CoCu/NbN-NPs.
如图1a所示,NbCl5在N2氛围下经直接氮化反应制得NbN-NPs;随后,采用初湿浸渍法将CoCl2⋅6H2O与CuCl2⋅2H2O的混合水溶液负载到NbN-NPs表面;通过HTS处理实现载体表面Cu2+与Co2+向单相合金的转化。TEM图像(图1b)显示HTS处理后CoCu/NbN-NPs的平均粒径为18.3 nm。CoCu/NbN-NPs的HR-TEM图像(图1c)中可观察到晶面间距分别为0.175 nm和0.260 nm的清晰晶格条纹,二者分别对应Co的(200)晶面与NbN的(111)晶面。SAED图谱(图1d)呈现典型的衍射环,可指标化为面心立方结构的金属Co,表明CoCu合金具有与金属Co相似的晶体结构。上述结果证实金属盐前驱体在HTS处理过程中发生分解并被还原为相应的合金。EDS mapping图像(图1e)显示,Co、Cu元素在催化剂中分布均匀,证明所制备的CoCu合金为成分均一的单相结构。上述结果共同证明超快的HTS工艺能够促进CoCu纳米晶的生成。
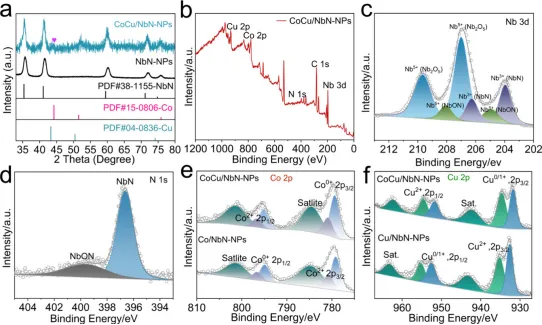
Figure 2. (a) XRD patterns of NbN-NPs and CoCu/NbN-NPs. (b) XPS survey spectrum of CoCu/NbN-NPs. High-resolution (c) Nb 3d and (d)N 1s XPS spectra of CoCu/NbN-NPs. (e) High-resolution Co 2p XPS spectra of CoCu/NbN-NPs and Co/NbN-NPs. (f) High-resolution Cu 2pXPS spectra of CoCu/NbN-NPs and Cu/NbN-NPs.
如图2a所示,NbN-NPs的XRD图谱中出现立方相NbN的特征衍射峰且未检测到其它杂质的衍射信号,表明NbCl5经直接氮化反应后,成功制得结晶度良好的立方相NbN-NPs。相较下,CoCu/NbN-NPs的XRD图谱在44.2°处出现一个新增与金属Co (111)晶面相匹配的衍射峰,上述结果表明经HTS处理后,CoCu/NbN-NPs中形成了单相合金结构。此外,衍射峰的宽化现象表明所得CoCu合金以小尺寸纳米团簇形式存在,说明HTS工艺不仅能够克服Cu与Co之间的固有不互溶性,还能有效抑制纳米晶的过度生长。CoCu/NbN-NPs的XPS全谱(图2b)证实N、Co、Cu、Nb四种元素的存在。NbN-NPs的Nb3d能谱可拟合为对应NbN、NbON和Nb2O5的特征峰,其中Nb的氧化物源于NbN-NPs暴露于空气中发生的表面氧化反应(图2c)。N1s能谱在结合能397.17 eV与399.60 eV处出现两个分别对应NbN相中的晶格氮和NbON相中的氮的分峰(图2d)。在Co2p能谱中(图2e),CoCu/NbN-NPs与Co/NbN-NPs均能识别出对应Co0(779.43 eV)和Co2+(781 eV)的Co2p3/2特征峰。Cu2p能谱(图2f)所示CoCu/NbN-NPs和Cu/NbN-NPs中均可检测到Cu0和Cu2+的Cu2p3/2特征峰,表明在HTS处理过程中Cu、Co阳离子均被还原为相应的金属单质。此外,相较于Co/NbN-NPs和Cu/NbN-NPs,CoCu/NbN-NPs中Co0的特征峰向高结合能方向偏移,Cu0的特征峰向低结合能方向偏移,表明CoCu/NbN-NPs中存在电子相互作用且电子由Co物质向Cu物质发生转移。上述结果共同证实经HTS处理后NbN-NPs载体的化学态保持稳定且CoCu合金成功形成。
NO3⁻RR的电催化性能
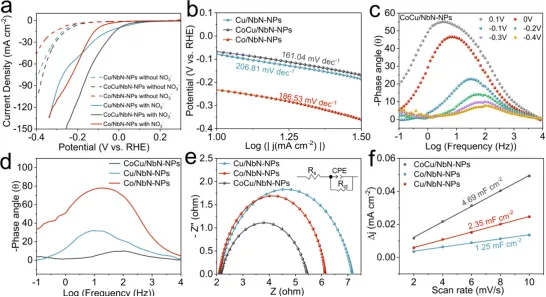
Figure 3. (a) LSV curves recorded in the electrolyte with or without NO3−and (b) the corresponding Tafel slopes of CoCu/NbN-NPs, Cu/NbNNPs, and Co/NbN-NPs. (c) Bode phase plots of CoCu/NbN-NPs at different potentials. (d) Bode plots at -0.3 V, (e) Nyquist plots at OCP(inset: the equivalent circuit model), and (f) fitting curves of double-layer capacitance (Cdl) of CoCu/NbN-NPs, Cu/NbN-NPs, and Co/NbNNPs.
如图3a所示,CoCu/NbN-NPs、Co/NbN-NPs及Cu/NbN-NPs三种催化剂在含NaNO3的电解液中均表现出高于无NaNO3电解液的电流密度,证实三者均具备NO3⁻RR催化能力。在含NaNO3的电解液中,当施加电位低于0 V时,相同电位下CoCu/NbN-NPs的电流密度显著高于Cu/NbN-NPs与Co/NbN-NPs,说明Cu与Co物质间的协同作用赋予了CoCu/NbN-NPs更优异的NO3⁻RR性能。Tafel曲线(图3b)对比结果显示CoCu/NbN-NPs的塔菲尔斜率为161.04 mV·dec-1,低于Cu/NbN-NPs(206.81 mV·dec-1)与Co/NbN-NPs(186.53 mV·dec-1),表明Cu与Co的复合显著加速了NO3⁻RR的反应动力学进程。析氢反应测试(图3c)结果显示所有催化剂的波特图特征峰均向高频区发生明显偏移且特征峰强度显著下降,说明电解液中引入NO3−后,电极表面的电荷累积程度大幅降低,意味着在相同电位下,NO3⁻RR的反应动力学速率快于析氢反应。如图3d所示,-0.3 V电位下三种催化剂的波特图中所有催化剂的特征峰均位于中频段,说明此时电解质-电极界面的电荷累积量极少,NO3⁻RR反应可顺利进行且RDS为反应物的扩散过程。此外,CoCu/NbN-NPs的最大相位角显著低于其他两种催化剂,表明CoCu/NbN-NPs上NO3⁻RR的电荷转移速率与电化学反应动力学速率最快。奈奎斯特图(图3e)显示CoCu/NbN-NPs的圆弧半径更小,对应电荷转移电阻更低,表明该催化剂的反应界面电阻更小。双电层电容法(Cdl)对催化剂的电化学活性表面积(ECSA)(图3f)计算结果显示CoCu/NbN-NPs的双电层电容值在所有样品中最高,说明该催化剂具有最多的暴露活性位点。综上表明CoCu/NbN-NPs具备快速的电子转移能力与丰富的暴露活性位点两大特性。
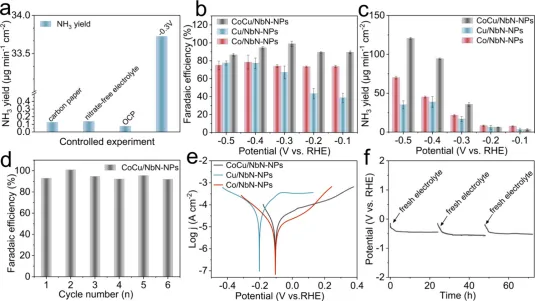
Figure 4. (a) Verification of the ammonia source. (b) Faradaic efficiencies of NH3 production and (c) NH3 yield rates at different potentials ofCoCu/NbN-NPs, Cu/NbN-NPs, and Co/NbN-NPs. (d) Continuous cycling test at -0.3 V of CoCu/NbN-NPs. (e) Potentiodynamic polarizationcurves of CoCu/NbN-NPs, Cu/NbN-NPs, and Co/NbN-NPs. (f) Chronopotentiometry test with the electrolyte replaced three times with CoCu/NbN-NPs.
如图4a所示,在含硝酸盐的电解液中未负载催化剂的空白碳纸对应的氨产率几乎可以忽略,表明碳纸本身对NO3⁻RR无催化活性,是一种适宜的催化剂负载载体。在无硝酸盐的电解液、-0.3 V电位下时,CoCu/NbN-NPs的氨产率同样低至可忽略。而在含硝酸盐的电解液、-0.3 V电位下测试时,CoCu/NbN-NPs的氨产率高达35.5 μg min-1cm-2,显著高于开路电位(OCP)条件下的产率。如图4b所示,在整个测试电位区间内三种催化剂的FE(NH3)均低于80%。Cu/NbN-NP的FE(NH3)随施加电位的负移呈逐步上升趋势,在-0.4 V时达到最大值77.19%。而CoCu/NbN-NPs在全测试电位区间内均维持较高的FE(NH3),在-0.3 V时高达98%,说明Co的引入可显著促进反应中间体快速还原为氨。在相同电位下,CoCu/NbN-NPs的氨产率高于单金属对照样品(图4c),进一步证实该催化剂相较单金属对照样品具有更优的催化活性与选择性。负载催化剂的电极在6次NO3⁻RR循环测试中可重复使用且FE(NH3)始终保持在90%以上(图4d),证实CoCu/NbN-NPs具备优异的催化稳定性。催化剂的腐蚀极化曲线(图4e)结果显示所有催化剂的腐蚀电流相近,但CoCu/NbN-NPs与Co/NbN-NPs的腐蚀电位均高于Cu/NbN-NPs。因此,Co的引入可提升CoCu/NbN-NPs的抗腐蚀性能。计时电位法(图4f)测试结果表明,测试电位仅出现轻微下降,证实该催化剂对NO3⁻RR具有优异的长期稳定性。
实际活性位点的反应机制
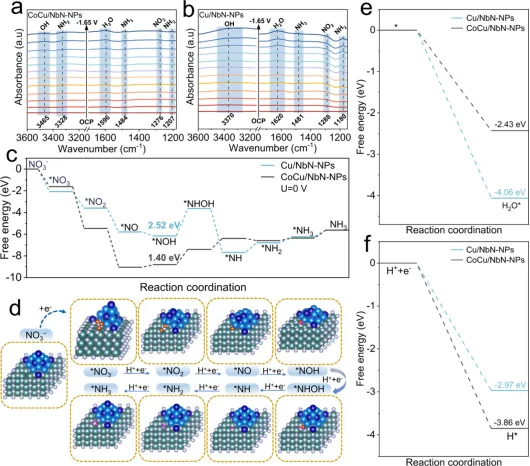
Figure 5. In situ FTIR spectra of (a) CoCu/NbN-NPs and (b) Cu/NbN-NPs from OCP to -1.65 V (vs Hg/HgO) in 1.0 M KOH with 0.1 MNaNO3. (c) Free-energy diagrams for the NO3−RR on CoCu/NbN-NPs and Cu/NbN-NPs at 0 V. (d) DFT-optimized NO3−RR configurations onCoCu/NbN-NPs. (e) Gibbs free energy of H2O adsorption and (f) Gibbs free energy of H* adsorption on CoCu/NbN-NPs and Cu/NbN-NPs.
如图5a-b所示,CoCu/NbN-NPs与Cu/NbN-NPs两种催化剂表面均检测到*NH2和*NH3的特征吸收峰,且*NH3吸收峰的强度随施加电位的负移逐渐增强。证实两种催化剂上NO3−向NH3的转化均以*NH2为中间体。CoCu/NbN-NPs与Cu/NbN-NPs在约1280cm-1处均出现*NO2的特征吸收峰。随着施加电位负移CoCu/NbN-NPs表面*NO2特征峰的强度降幅显著大于Cu/NbN-NPs,表明在NO3−RR过程中,CoCu/NbN-NPs对该中间体的消耗速率更快。通过DFT计算以探究NO3−RR在CoCu/NbN-NPs表面的反应机制。如图5c所示,在0 V电位下,CoCu/NbN-NPs上RDS的能垒为1.40 eV,显著低于Cu/NbN-NPs的2.52 eV,证明Co的引入可大幅提升反应动力学速率,促进中间体在实际电解条件下快速转化为NH3。此外,中间体在两种催化剂表面的吸附构型(图5d)显示CoCu团簇与NbN载体的界面区域是中间体的优先吸附位点,表明NbN载体对NO3−RR的催化反应具有关键的促进作用。H2O与H∗在两种催化剂表面的吸附行为(图5e-f)结果显示,Cu/NbN-NPs与CoCu/NbN-NPs对H2O的吸附吉布斯自由能均为负值,说明两种催化剂均可实现对H2O的强吸附。而CoCu/NbN-NPs对H∗的吸附作用更强,可有效抑制竞争性HER的发生,同时促进H∗富集,为NO3−RR中间体的加氢反应提供充足原料。
用于增强NO3−RR性能的活性界面边缘
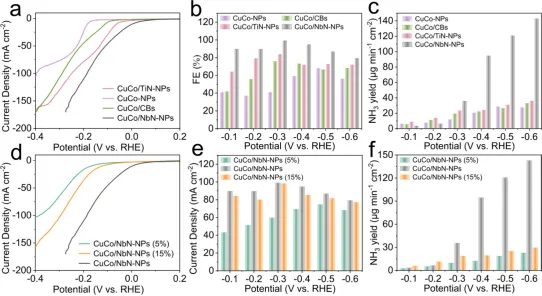
Figure 6. (a) LSV curves, (b) FE(NH3) at various applied potentials, and (c) NH3 yield rates at various applied potentials of CoCu/NbN-NPs,CoCu/TiN-NPs, CoCu-NPs, and CoCu/CBs. (d) LSV curves, (e) FE(NH3) at various applied potentials, and (f) NH3 yield rates at variousapplied potentials of CoCu/NbN-NPs (5%), CoCu/NbN-NPs, and CoCu/NbN-NPs (15%).
如图6a-c所示,对比不同催化剂的NO3−RR性能结果显示CoCu/NbN-NPs与CoCu/TiN-NPs的催化活性显著优于CoCu-NPs与CoCu/CBs,表现出更正的起始电位,以及更高的FE(NH3)和氨产率。在NbN载体上制备了一系列CoCu负载量(质量分数5%、10%和15%)可控的催化剂,以探究总界面边缘长度对NO3−RR的关键作用。电化学性能数据(图6d-f)显示,在相同施加电位下,CoCu/NbN-NPs(10%)的电流密度、FE(NH3)及氨产率均为三者中最高。
Zn-NO3−电池性能评估
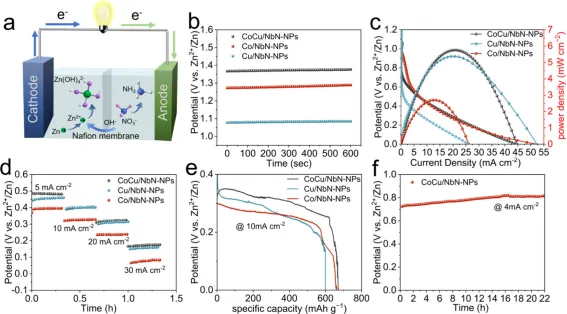
Figure 7. (a) Schematic illustration of the assembled Zn-NO3− battery. (b) Open-circuit potentials, (c) polarization and powerdensity curves, (d)discharging tests at various current densities, and (e) voltage profiles versus specific capacities for CoCu/NbN-NPs, Cu/NbN-NPs, and Co/NbNNPs. (f) Chronopotentiometry curve of the Zn-NO3− battery based on CoCu/NbN-NPs.
如7a所示,本研究组装了以CoCu/NbN-NPs为阴极材料的Zn-NO3−电池。在放电过程中,阴极发生反应生成NH3,阳极的锌箔发生氧化反应。基于CoCu/NbN-NPs组装的Zn-NO3−电池表现出1.37 V的稳定开路电位(图7b),其高于以Co/NbN-NPs和Cu/NbN-NPs为阴极的电池。Zn-NO3−电池的放电曲线及对应的功率密度图(图7c)显示搭载CoCu/NbN-NPs阴极的电池峰值功率密度达5.75 mW cm-2,显著高于Cu/NbN-NPs基电池(5.38 mW cm−2)与Co/NbN-NPs基电池(2.7 mW cm−2)。此外,在5-40 mA cm-2的测试电流密度区间内,相同电流密度下CoCu/NbN-NPs基电池的输出电位均高于Co/NbN-NPs基与Cu/NbN-NPs基电池,表明其具备更优异的倍率性能(图7d)。CoCu/NbN-NPs基Zn-NO3−电池的比容量高达672 mAh g−1,超过了另外两种单金属催化剂基电池(图7e)。在4 mA cm-2的电流密度下连续测试22 h(图7f)结果表明,CoCu/NbN-NPs基电池具有良好的长期稳定性。综上,CoCu/NbN-NPs基Zn-NO3−电池展现出优异的综合性能,优于Co/NbN-NPs基与Cu/NbN-NPs基电池,证实该电池可实现电能供应与硝酸盐还原制氨的同步进行。